La extracción es una de las operaciones más básicas del laboratorio. Se define como la acción de separar con un líquido una fracción específica de una muestra, dejando el resto lo más íntegro posible. Se pueden realizar desde los tres estados de la materia, y se llaman de la siguiente manera: Extracción sólido – líquido; extracción líquido – líquido y extracción gas – líquido.
En el laboratorio químico, es frecuente utilizar mezclas complejas de diferentes compuestos. Casi siempre que se lleva a cabo una reacción de preparación de un compuesto determinado, es necesario separar este producto de la mezcla de reacción donde puede haber subproductos formados en la reacción, sales u otras impurezas. Así, en el laboratorio químico la separación y la purificación del producto deseado son tan importantes como la optimización de su síntesis, con lo cual, además de mejorar las condiciones de reacción buscando un elevado rendimiento de formación del producto deseado, se tienen que plantear procesos eficientes de separación que permitan una recuperación máxima del producto a partir de la mezcla de reacción. La extracción es una te las técnicas más útiles para hacerlo.
Fundamentalmente la separación de un compuesto por extracción, se basa en la transferencia selectiva del compuesto desde una mezcla sólida o líquida con otros compuestos hacia una fase líquida (normalmente un disolvente orgánico). El éxito de la técnica depende básicamente de la diferencia de solubilidad en el disolvente de extracción entre el compuesto deseado y los otros compuestos presentes en la mezcla inicial. El objetivo de la extracción es separar selectivamente el producto de una reacción, o bien eliminar las impurezas que lo acompañan en la mezcla de reacción, gracias a sus diferencias de solubilidad en el disolvente de extracción elegido.
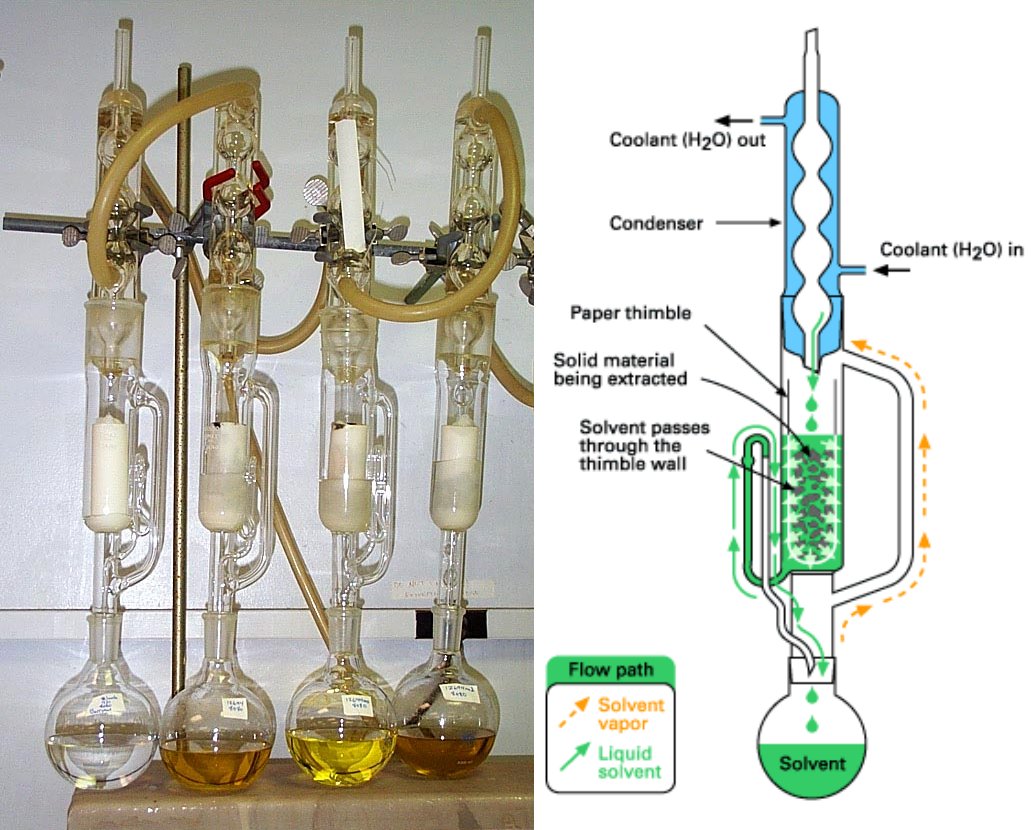
Ahora bien ante la pregunta de la necesidad de usar un aparato bastante complejo y costoso para extraer un sólido con un solvente, algo que pareciera tan sencillo de hacer agregando el solvente a la muestra y luego filtrar y listo, hay que tomar en cuenta lo siguiente; el proceso de extracción de la mayoría de las sustancias tiene muy baja eficiencia, es decir una vez que se agrega el solvente, lo que está en contacto íntimo con lo extraíble se satura enseguida, por lo que hay que filtrar y volver a tratar con solvente fresco. Eso implica gran cantidad y mucha manipulación del solvente aparte de la atención personalizada que la operación requiere. Como muchas veces lo que se quiere recuperar es el extracto y no la muestra extraída, habrá que evaporar todo el solvente para recuperarlo. Y con lo anterior no hay que olvidar que estas tareas debieran realizarse en una campana espaciosa dado que los solventes se suelen utilizar calientes, es decir con una alta tensión de vapor.
Lo que hace el extractor Soxhlet es realizar un sin fin de extracciones de manera automática, con el mismo solvente que se evapora y condensa llegando siempre de manera pura al material. Recuerda contactarnos y preguntar a nuestros expertos. Recuerda ¡tu éxito es nuestra pasión!







Comment